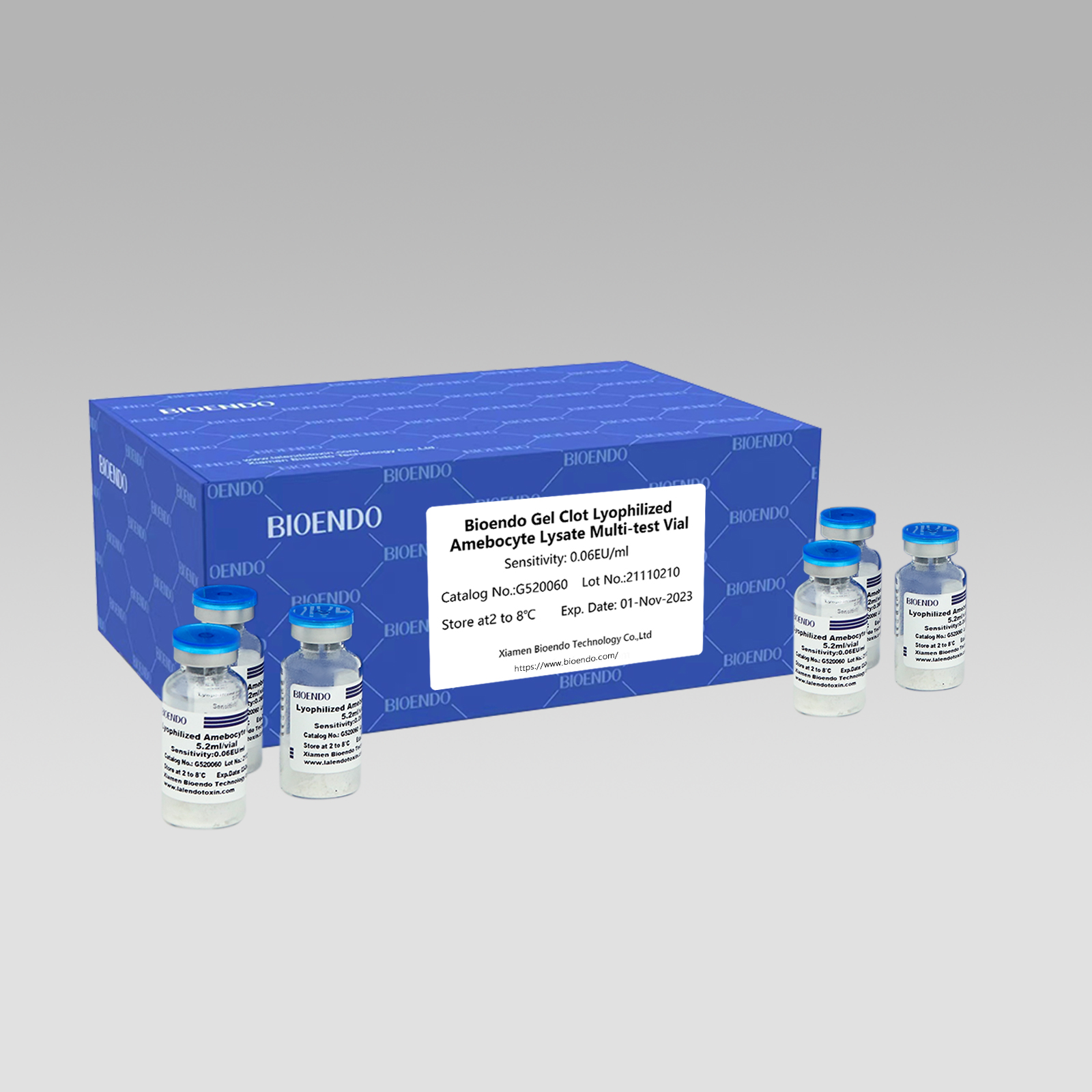
Gel-Clot Lyophilisiertes Amöbozyten-Lysat-Multitestfläschchen G52
Die Bioendo G52-Serie wird hauptsächlich im Experimentierbetrieb eingesetztBakterien-Endotoxin-Testals Bioassay-Verfahren.
1. Produktinformationen
Gel-Clot-Methode Lyophilisiertes Amöbozyten-Lysat-Multitestfläschchen ist das lyophilisierte Amöbozyten-Lysat-Reagenz, das die Gel-Clot-Technik zum Nachweis von Endotoxin oder Pyrogen auswählt und verwendet.
Als weit verbreitete Methode ist der Gel-Gerinnseltest auf Endotoxin einfach und erfordert kein spezielles und teures Instrument.Bioendo bietet Gel-Clot Lyophilized Amöbozyten-Lysat – LAL-Reagenz in 5,2 ml pro Fläschchen.
2. Produktparameter
Empfindlichkeitsbereich: 0,03 EU/ml, 0,06 EU/ml, 0,125 EU/ml, 0,25 EU/ml, 0,5 EU/ml
3. Produktanwendung
Qualifizierung des Endprodukts Endotoxin (Pyrogen), Wasser für InjektionszweckeEndotoxin-Assay, RohmaterialEndotoxintestoder die Überwachung des Endotoxinspiegels während des Herstellungsprozesses für Pharmaunternehmen oder Hersteller medizinischer Geräte.
Notiz:
Von Bioendo hergestelltes lyophilisiertes Amöbozytenlysat (LAL-Reagenz) wird aus Lysat von Amöbozyten (weißen Blutkörperchen) des Pfeilschwanzkrebses hergestellt.
Dieses einzigartige Reagenz ist in der Pharma- und Medizingeräteindustrie zu einem unverzichtbaren Hilfsmittel für den Nachweis bakterieller Endotoxine geworden.Die Amöbozyten des Pfeilschwanzkrebses enthalten eine Substanz namens Lyophilisiertes Amöbozytenlysat, die auf bakterielle Endotoxine reagiert, indem sie ein gelartiges Gerinnsel bildet.Diese Reaktion ist die Grundlage für den LAL-Test, der zur Gewährleistung der Sicherheit von Medizinprodukten, Medikamenten und anderen Produkten verwendet wird, die mit dem menschlichen Körper in Kontakt kommen.
Die Verwendung von LAL-Reagenz hat den Prozess revolutioniertEndotoxin-Nachweisim medizinischen Bereich als der Rabit-Test.Seine beispiellose Sensitivität und Spezifität machen es zu einem entscheidenden Bestandteil bei der Qualitätskontrolle und Sicherheitssicherung von Arzneimitteln, Biologika und Medizinprodukten.Der LAL-Test ist eine schnelle und zuverlässige Methode zurEndotoxin-Nachweisund liefert Ergebnisse in nur 60 Minuten.Diese Effizienz ermöglicht schnelle und genaue Entscheidungen hinsichtlich der Freigabe von Produkten und verbessert letztendlich die allgemeine Sicherheit und Wirksamkeit medizinischer Behandlungen und Geräte.
Das lyophilisierte Amöbozytenlysat (LAL-Reagenz) von Bioendo wird unter strengen Qualitätsstandards hergestellt, um seine Wirksamkeit und Zuverlässigkeit sicherzustellen.Das Unternehmen ist bestrebt, beim Fang von Pfeilschwanzkrebsen nachhaltige Praktiken anzuwenden, um negative Auswirkungen auf die Population zu minimieren.Durch die Priorisierung des Wohlergehens dieser Lebewesen stellt Bioendo eine kontinuierliche Versorgung mit dieser wertvollen Ressource für die Produktion von LAL-Reagenzien sicher.Darüber hinaus konzentrieren sich die laufenden Forschungs- und Entwicklungsbemühungen auf die Verbesserung der Leistung und Vielseitigkeit vonLAL-Test Endotoxin, was ihren Nutzen in der medizinischen und pharmazeutischen Industrie weiter steigert.
Gel-Clot-MethodeLAL-Assay, rekonstituiertes Lysat-Reagenz, mindestens 50 Tests pro Fläschchen durchführen:
| Katalognummer | Empfindlichkeit (EU/ml oder IU/ml) | ml/Fläschchen | Tests/Fläschchen | Fläschchen/Packung |
| G520030 | 0,03 | 5.2 | 50 | 10 |
| G520060 | 0,06 | 5.2 | 50 | 10 |
| G520125 | 0,125 | 5.2 | 50 | 10 |
| G520250 | 0,25 | 5.2 | 50 | 10 |
| G520500 | 0,5 | 5.2 | 50 | 10 |
Produktzustand:
Die Empfindlichkeit des lyophilisierten Amöbozytenlysats - LAL-Reagenzes und die Wirksamkeit des Kontrollstandard-Endotoxins werden im Vergleich zum USP-Referenzstandard-Endotoxin getestet.Den Reagenzienkits für lyophilisierte Amöbozyten liegt eine Produktanleitung, ein Analysezertifikat und ein Sicherheitsdatenblatt bei.
Was ist der Unterschied zwischen einem Bioendo-Einzeltestfläschchen und einem Mehrfachtestfläschchen?
● Single-Test: Rekonstituieren Sie die SingleLimulus-Lysat-Testoder angerufenLimulus-Amöbozytendurch BET-Wasser im Glasfläschchen oder Glasampulle.
● Mehrfachtest: Rekonstituieren Sie das Lysatreagenz mit BET-Wasser und geben Sie dann nach COA die markierte Menge Lysatreagenz zur Verwendung in das Reaktionsröhrchen oder die Wellplatte.Es gibt keinen Unterschied im Probenvorverarbeitungsverfahren;Abhängig vom verwendeten Testumfang ist die Stichprobengröße für einen einzelnen Test größer als die Stichprobengröße für mehrere Tests.
Warum ist das Gel-Gerinnsel-Assay-Kit G52 speziell für die Menge von Massenproben geeignet?
1. Multitest-LAL-Reagenz für den Endotoxinnachweis bei der Anwendung von LAL-Assay-Verfahren für Massenproben.
2. G52-Serie von Gel-Gerinnsel-Endotoxin-Assay-Multitest-Glasfläschchen, kein hochentwickeltes Mikroplatten-Lesegerät erforderlich.Beim LAL-Assay ist das Inkubationsverfahren im Wasserbad oder im Trockenhitze-Inkubator ein praktisches Gerät.
3. Hochwertige endotoxinfreie Röhrchen (<0,005 EU/ml) und hochwertige pyrogenfreie Spitzen (<0,005 EU/ml) als garantierte Verbrauchsmaterialien, um das korrekte Ergebnis zu gewährleisten.
4. Das Ziel ist, ein Bioendo-Einzel-LAL-Testfläschchen oder ein Multi-LAL-Testfläschchen nach Probenmenge auszuwählenLAL-Test auf PyrogeneErkennung.
Verwandte Produkte im Endotoxin-Test:
Wasser für den Test auf bakterielle Endotoxine (BET), empfohlen TRW50 oder TRW100
Endotoxinfreies Glasröhrchen (Verdünnungsröhrchen), empfohlen T1310018 und T107540
Pyrogenfreie Spitzen, empfehlen PT25096 oder PT100096
Pipettierer, empfehlen Sie PSB0220
Reagenzglasgestell
Inkubationsinstrument (Wasserbad oder Trockenhitze-Inkubator), zu empfehlen ist der Bioendo Trockenhitze-Inkubator TAL-M2 mit 60 Löchern und einem Modul.
Vortex-Mischer, empfehlen Sie VXH.
Kontrollstandard-Endotoxin, CSE10V.